
7月13日,貝達藥業(yè)收到國家藥品監(jiān)督管理局簽發(fā)的《受理通知書》(受理號:CXHS2101028國、CXHS2101029國),公司申報的鹽酸恩沙替尼膠囊(貝美納?)擬用于 “適用于間變性淋巴瘤激酶(ALK)陽性的局部晚期或轉移性非小細胞肺癌(NSCLC)患者的治療”的上市許可申請已獲得國家藥品監(jiān)督管理局受理。
鹽酸恩沙替尼是一種新型強效、高選擇性的新一代ALK抑制劑,是貝達藥業(yè)和控股子公司Xcovery共同開發(fā)的全新的、擁有完全自主知識產(chǎn)權的創(chuàng)新藥。2020年11月,鹽酸恩沙替尼膠囊正式獲批上市,獲批的適應癥為:適用于此前接受過克唑替尼治療后進展的或者對克唑替尼不耐受的間變性淋巴瘤激酶(ALK)陽性的局部晚期或轉移性非小細胞肺癌(NSCLC)患者的治療(即二線治療適應癥)。恩沙替尼成為中國第一個用于治療ALK突變晚期非小細胞肺癌的國產(chǎn)1類新藥。
本次采用eXalt3研究結果申報一線治療適應癥。eXalt3 研究是一項全球開放多中心隨機對照Ⅲ期臨床研究,涉及21個國家和地區(qū)的123個研究中心,全球總計入組290名患者,中國入組140名患者。試驗組為恩沙替尼225mg QD方案,直至疾病進展;對照組為克唑替尼250mg BID方案,直至疾病進展,兩組之間不允許交叉。主要研究終點為BIRC評估的ITT人群的mPFS;關鍵次要研究終點為OS, ORR/DOR (overall and brain), TTF in the brain, QOL (EORTC, LCSS)。
2020年8月,美國范德堡大學Leora Horn博士在世界肺癌大會(IASLC WCLC)主席團研討會(Presidential Symposium)上首次報告了eXalt3研究結果。2021年1月,廣東省人民醫(yī)院吳一龍教授在2020年世界肺癌大會(WCLC)會上發(fā)布了恩沙替尼eXalt3 研究最新數(shù)據(jù)。
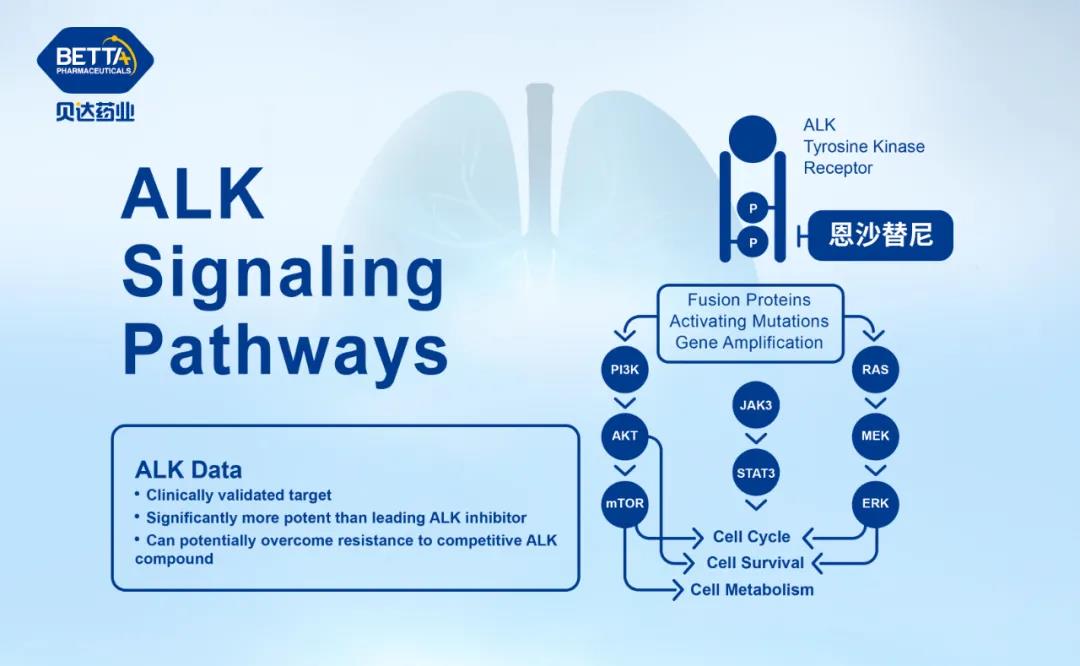
△ 鹽酸恩沙替尼作用機理圖
研究結果顯示,截至2020年12月8日,在意向治療(ITT)人群中,恩沙替尼組患者的中位PFS(基于獨立評審委員會IRC)顯著長于克唑替尼組(31.3個月vs12.7個月),而在mITT人群中,恩沙替尼INV評估的中位PFS達到33.2個月,隨訪中位數(shù)為27.6個月。恩沙替尼組2年的OS率為78%,也證實了恩沙替尼組患者OS的良好趨勢。患者生活質量隨訪報告的結果顯示恩沙替尼治療組患者較克唑替尼治療組患者的生活質量明顯改善。
貝達藥業(yè)副總裁季東表示,eXalt3 研究恩沙替尼PFS顯著延長,較克唑替尼顯著改善患者生活質量,恩沙替尼是ALK突變晚期非小細胞肺癌患者一線治療的全新選擇。基于eXalt3研究,公司正積極準備美國一線適應癥的上市申報,恩沙替尼有望成為首個由中國企業(yè)主導在全球上市的肺癌靶向創(chuàng)新藥,相信未來成功上市后將會全線出擊,在ALK陽性NSCLC患者全程管理中全面守護患者生命。
貝達藥業(yè)副總裁馬勇斌表示,作為公司首個以國際多中心臨床數(shù)據(jù)進行上市申報的項目,項目在進行過程中遇到很多挑戰(zhàn)。為此,項目組成員認真研讀法規(guī)政策,制定了切實可行的注冊策略,為順利申報提供了重要保障。本次注冊申請資料多、時間緊、任務重、要求高,貝達藥業(yè)醫(yī)學部、注冊部等各部門緊密配合,并與Xcovery公司高效聯(lián)動,全力快速推進項目,提前完成申報,為后續(xù)項目積累了豐富的國際多中心臨床和注冊經(jīng)驗。下一步,我們將竭盡全力做好后續(xù)工作,爭取恩沙替尼一線適應癥早日獲批上市,惠及廣大患者。
下一條: 貝達藥業(yè)黨委書記、副總裁馬勇斌榮獲“省優(yōu)秀共產(chǎn)黨員”稱號
