
9月16日-21日,2021年歐洲腫瘤內科學會(ESMO)年會-虛擬會議舉行。貝達藥業甲磺酸貝福替尼(BPI-D0316)和貝伐珠單抗注射液(MIL60)臨床研究成果以壁報形式在會議上展示。
評估貝福替尼對比埃克替尼作為在既往未經治療的EGFR敏感突變局部晚期或轉移性非小細胞肺癌患者一線治療中的療效和安全性的III期臨床研究

01 研究背景
研究顯示表皮生長因子受體酪氨酸激酶抑制劑(EGFR-TKI)在治療晚期EGFR突變方面比化療展現出更好的療效。然而,大多數患者在接受第一代/第二代EGFR-TKIs治療后會出現不同程度的耐藥性。貝福替尼(Befotertinib) 是第三代EGFR-TKI,對EGFR敏感突變(19號外顯子缺失和21號外顯子L858R突變)或T790M突變具有選擇性。該療效已在II期研究(NCT03861156)中得到證實。該研究報告表明,在接受一代EGFR-TKI治療出現疾病進展并已確診為EGFR T790M突變的非小細胞肺癌患者中,接受貝福替尼治療后,患者客觀應答率(ORR)為64.8%,疾病控制率(DCR)為95.2%。基于上述研究成果,我們開展了一項多中心、隨機、開放、平行對照的III期研究(NCT04206072),以評估貝福替尼對比埃克替尼(icotonib)作為在既往未經治療的EGFR敏感突變局部晚期或轉移性非小細胞肺癌患者一線治療中的療效和安全性。
02 患者入選標準
本研究采用優效設計,研究納入年齡≥18歲局部晚期或轉移性非小細胞肺癌EGFR突變陽性(19號外顯子缺失或21外顯子L858R突變,兩者單獨存在或與其他EGFR位點突變共存均可)的未接受治療的患者。
03 研究方案
符合條件的患者將被隨機分配到服用埃克替尼(口服125 mg Tid)或貝福替尼 (75 mg QD; 21天/周期。治療1個周期后,若未發生CTCAE 4.03≥2級的血小板降低或頭痛,則升高劑量至100 mg QD,否則將維持75 mg QD),直至出現疾病進展(RECIST v1.1),滿足退出標準或研究終止標準。
04 研究終點
主要終點是由獨立審查委員會評估的無進展生存期(PFS)。次要終點是客觀緩解率、疾病控制率、顱內客觀緩解率(iORR)、顱內無進展生存期(iPFS)、總生存期(OS)、緩解持續時間(DOR)和安全性。
05 統計分析
本研究貝福替尼組和埃克替尼組人群皆為既往未經治療的EGFR敏感突變局部晚期或轉移性非小細胞肺癌患者,樣本量是在假設風險比(HR)為0.625情況下指定的。相應的PFS由埃克替尼組預期的10個月增加到貝福替尼組的16個月,檢驗效能取86%,檢驗水準單側取0.025,20%的脫落率。
06 目前進展
這項研究已在中國的40家中心進行。截至2020年12月18日,患者招募工作已完成。患者數據目前正在隨訪。
評估MIL60聯合紫杉醇/卡鉑與貝伐珠單抗聯合紫杉醇/卡鉑治療晚期或復發性非鱗狀細胞非小細胞肺癌(NSCLC)初治受試者的有效性和安全性的III期臨床研究
01 研究方案
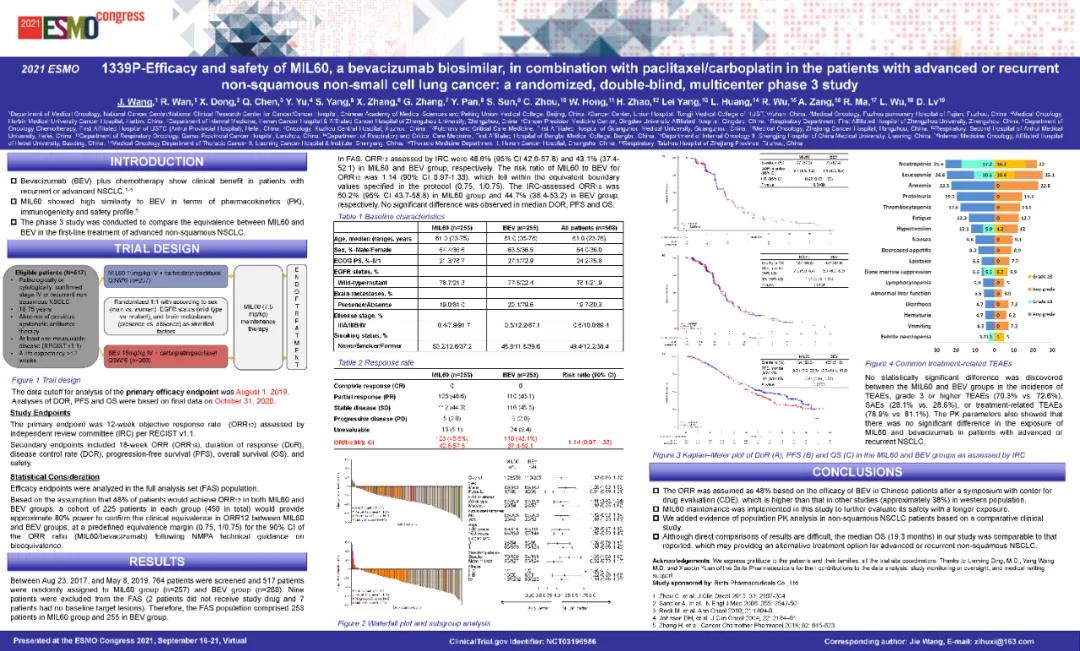
MIL60是貝伐單抗的生物類似藥,可結合和抑制血管內皮生長因子。本研究是一項隨機、雙盲、多中心、陽性藥對照的III期臨床研究(NCT03196986),主要評估MIL60聯合紫杉醇/卡鉑與貝伐珠單抗聯合紫杉醇/卡鉑治療晚期或復發性非鱗狀細胞非小細胞肺癌(NSCLC)初治受試者的有效性和安全性。主要終點是比較兩組治療晚期或復發性非鱗狀細胞NSCLC患者12周的客觀緩解率(ORR12)。次要終點包括18周的客觀緩解率(ORR18)、緩解持續時間(DOR)、無進展生存期(PFS)、疾病控制率(DCR)和總生存期(OS)。探索性目的包括群體藥代動力學(Pop PK)特征和免疫原性。
以1:1的比例隨機分配到MIL60(15 mg/kg)聯合紫杉醇+卡鉑治療組(MIL60組)或貝伐珠單抗(15 mg/kg)聯合紫杉醇+卡鉑治療組(BEV組)中,分層因素包括性別、表皮生長因子受體(EGFR)基因狀態(野生型vs突變型),以及有無腦轉移。本研究計劃入組510例受試者,MIL60組和貝伐珠單抗組各入組255例。研究間期每例受試者接受每3周(±3天)為一個治療周期的治療,隨后進行MIL60單藥(7.5mg/kg)維持治療,直至出現PD、無法耐受的毒性反應、采用其他抗腫瘤治療、撤回知情同意、失訪、死亡或整個研究結束。
02 研究結果
2017年8月23日至2019年5月8日,517名患者被隨機分為MIL60組(n=257)和BEV組(n=260)。
在全分析人群(FAS)中,截止到2019年8月1日,MIL60組和BEV組的ORR12分別為48.6%和43.1%。兩組IREC評估的ORR12比值(含分層因素)為1.14,其90% CI為(0.970,1.332),在預先規定的等效邊界內(0.75-1/0.75)。
次要終點分析基于2020年10月31日的更新數據。MIL60的中位DOR為5.7個月(95% CI 4.5-6.2),BEV的中位DOR為5.6個月(95% CI 4.3-6.4)。中位PFS(7.2個月vs. 8.1個月;HR 1.01,95% CI 0.78-1.30,p=0.9606)和OS(19.3個月vs. 16.3個月;HR 0.81,95% CI 0.64-1.02,p=0.0755)無顯著差異。兩組的安全性和耐受性相似。
MIL60組和BEV組的不良事件(TEAE)(99.6% vs. 98.8%)和不良反應(TRAE)(78.9% vs. 81.1%)相似。3級及3級以上TEAE(70.3% vs. 72.6%)、3級及3級以上TRAE(34.4% vs. 39.0%)、嚴重不良事件(SAE)(28.1% vs 28.6%)、與MIL60/貝伐珠單抗相關的SAE(15.2% vs 16.2%)、導致死亡的TEAE(2.0% vs 1.9%)均無顯著差異。
MIL60和貝伐珠單抗在血漿中的暴露量[AUC和達峰濃度(Cmax)]無顯著性差異,說明MIL60和貝伐珠單抗在晚期或復發性非鱗狀細胞NSCLC受試者中具有相似的Pop PK的特征。
MIL60組和貝伐珠單抗組均無受試者在接受研究藥物后出現ADA陽性。對所有ADA陽性的受試者均進行了NAb檢測,檢測結果均為陰性。
03 結論
MIL60與BEV治療非鱗狀NSCLC的臨床療效相當,其安全性、Pop PK和免疫原性與BEV相似。
下一條: 2021 WCLC: 恩沙替尼國內注冊Ⅱ期臨床ctDNA探索性研究最新結果公布
