新聞中心 / News Center
貝達藥業PD-L1抑制劑BPI-371153膠囊藥品臨床試驗申請獲受理
日期: 2021-11-15
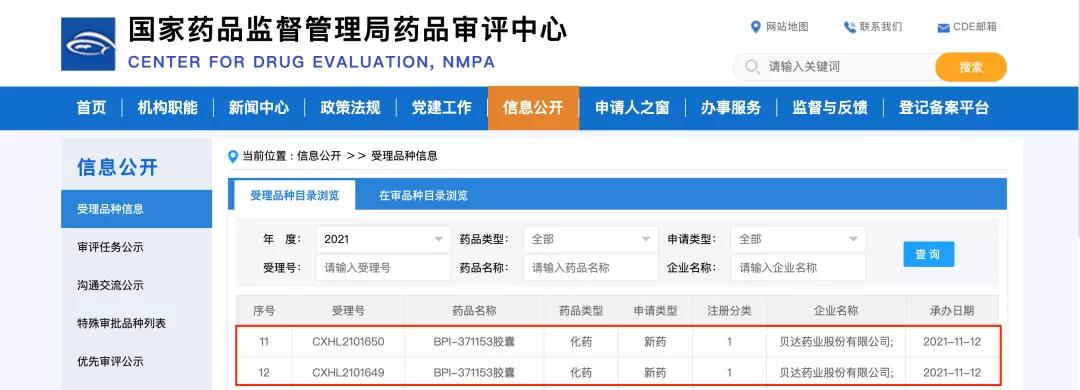
11月15日,貝達藥業收到國家藥品監督管理局簽發的《受理通知書》(受理號:CXHL2101649國;CXHL2101650國),公司申報的BPI-371153膠囊的藥品臨床試驗申請已獲得國家藥品監督管理局受理。
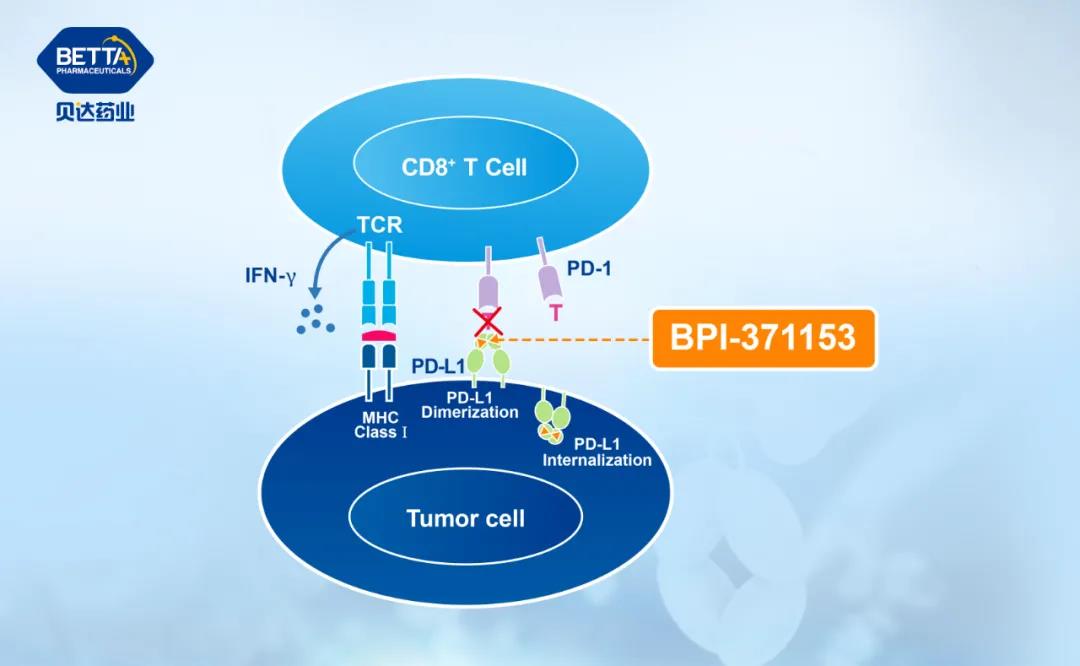
△BPI-371153作用機理圖
BPI-371153是由貝達藥業股份有限公司自主研發的新分子實體化合物,屬于新型強效、高選擇性的口服PD-L1(Programmed Cell Death 1 Ligand 1)小分子抑制劑。本品擬用于局部晚期或轉移性實體瘤或復發/難治性淋巴瘤患者的治療。
臨床前數據顯示,BPI-371153可有效誘導和穩定PD-L1二聚體的形成及內吞,從而強有力地阻斷PD-L1/PD-1相互作用。臨床前研究中展現出優秀的體外及體內活性、良好的安全性及藥代動力學性質。

△BPI-371153項目團隊合影
貝達藥業副總裁兼北京研發中心主任蘭宏博士表示,截至目前,全球尚無獲批或已上市的PD-L1小分子抑制劑,BPI-371153有望成為全球首批上市的小分子PD-L1抑制劑。相較于單克隆抗體,小分子PD-L1抑制劑可口服,提高患者的依存性,在生產工藝、劑型及給藥方式等多種層面的研究也較為成熟,且成本低,同時也可避免大分子藥物引起的免疫原性反應。其口服給藥這一特點,未來在聯合用藥中將展現出極強的競爭優勢,具有巨大的市場潛力。期待BPI-371153早日進入臨床研究,為患者提供更多益處。
下一條: 浙江省生命健康產業創新委員會成立 丁列明博士當選主席
熱門點擊
