日前,貝達藥業CDK4/6抑制劑BPI-16350 Ⅲ期臨床研究完成最后一例受試者入組。
BPI-16350 Ⅲ期研究全稱為“BPI-16350聯合氟維司群對比安慰劑聯合氟維司群治療既往接受內分泌治療后進展的HR+/HER2-的局部晚期、復發或轉移性乳腺癌受試者的多中心、隨機、雙盲、安慰劑對照的Ⅲ期臨床研究(方案編號:BTP-66732)”,主要研究者為復旦大學附屬腫瘤醫院胡夕春教授、中山大學附屬腫瘤醫院王樹森教授。該研究在全國63家研究中心合計招募267例受試者,于2022年6月6日,完成III期研究首例受試者入組。日前,完成隨機對照研究的最后一例受試者入組。
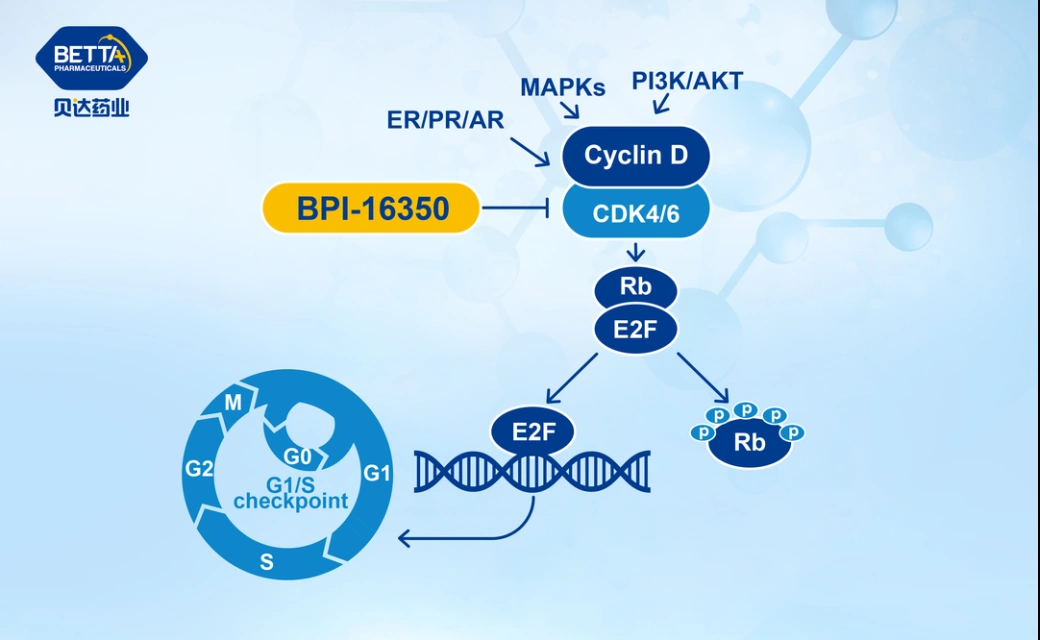
△BPI-16350作用機理圖
BPI-16350膠囊是貝達藥業自主研發的全新的、擁有完全自主知識產權的新分子實體化合物。其針對的靶點為細胞周期蛋白依賴性激酶4/6(CDK4/6),擬單藥或與激素療法聯合,主要用于治療HR陽性/HER2陰性的晚期或轉移乳腺癌患者,還可能用于Rb+的其他癌癥的一、二線或聯合治療。
臨床前數據顯示,BPI-16350膠囊在動物體內外生物學活性一致,能有效抑制多種實體瘤腫瘤細胞增殖,單藥或聯合用藥在多個實體瘤模型上展現了良好的抗腫瘤作用,同時理化及藥代動力學性質優秀。2018年6月,BPI-16350膠囊獲得國家藥品監督管理局批準開展臨床試驗,獲得了不錯的臨床療效數據。
貝達藥業副總裁季東表示,BPI-16350 III期研究順利完成入組,感謝臨床研究中心和專家們的支持,期待BPI-16350 膠囊早日提交NDA申報,早日獲批,為患者的治療提供更多更優的選擇方案。
貝達藥業資深副總裁蔡萬裕表示,作為創新型制藥企業,貝達一直在創新藥臨床研究深耕,BPI-16350是公司自主研發的重磅新藥項目,非常高興能順利完成受試者入組節點,期待產品早日上市,惠及患者。
下一條: 貝達藥業貝福替尼術后輔助III期臨床研究首例受試者入組
