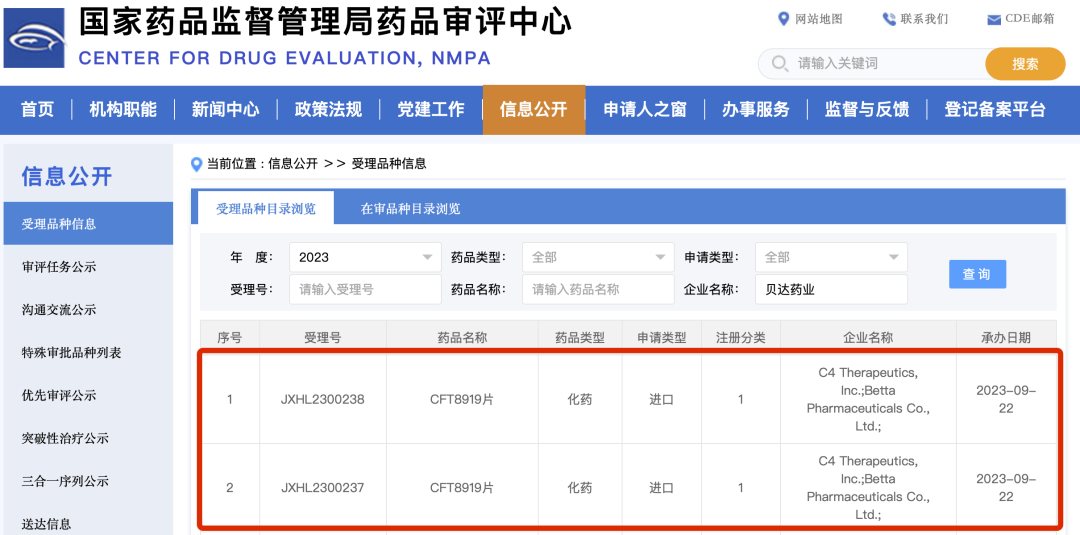
近日,貝達(dá)藥業(yè)收到國家藥品監(jiān)督管理局簽發(fā)的《受理通知書》(受理號:JXHL2300237、JXHL2300238),公司從C4 Therapeutics, Inc. (C4T)引進(jìn)的CFT8919片攜帶EGFR突變的非小細(xì)胞肺癌患者適應(yīng)癥臨床試驗(yàn)申請獲國家藥品監(jiān)督管理局受理。
今年7月,C4T收到了美國食品藥品監(jiān)督管理局簽發(fā)的《藥物臨床試驗(yàn)批準(zhǔn)通知書》,允許CFT8919片在美國開展Ⅰ/Ⅱ期臨床試驗(yàn)。CFT8919片是公司從C4T引進(jìn)的一種具有口服生物利用度的變構(gòu) BiDAC? 降解劑,對攜帶EGFR外顯子21(L858R)突變具有良好的活性和選擇性,同時對T790M或C797S突變的EGFR繼發(fā)耐藥突變有效。
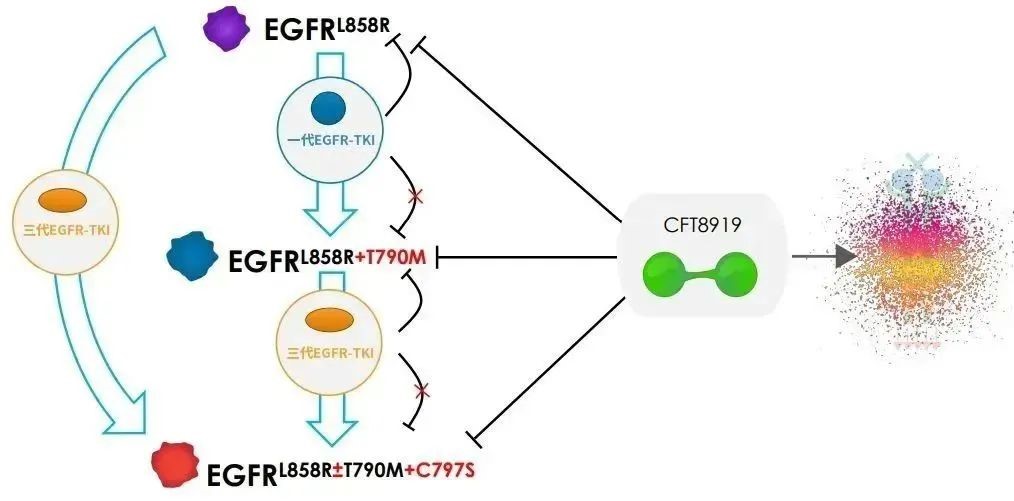
△CFT8919作用機(jī)理圖(來源:C4T)
多個大型隨機(jī)對照試驗(yàn)亞組分析結(jié)果顯示,一代、二代和三代EGFR-TKI治療19del和21L858R突變患者顯示出了不同的療效,總體來看,19del突變患者的獲益要明顯高于21L858R突變的患者。對于攜帶21L858R突變NSCLC患者,臨床上仍存在較大的未滿足需求,期待更好的治療方案。
貝達(dá)藥業(yè)副總裁、項(xiàng)目總負(fù)責(zé)人王三虎表示,臨床前研究中,CFT8919片在EGFR L858R 驅(qū)動的NSCLC 的體內(nèi)外模型中具有活性,可靶向廣泛的在靶耐藥突變并有顱內(nèi)活性,具有預(yù)防或治療患者腦轉(zhuǎn)移的潛力。貝達(dá)從C4T 引進(jìn)的CFT8919片能為EGFR L858R 突變患者提供嶄新的治療選擇,造福廣大患者。
貝達(dá)藥業(yè)董事長丁列明表示,CFT8919片是公司在靶向蛋白降解領(lǐng)域的一次探索,公司已有一代、三代EGFR-TKIs上市產(chǎn)品,以及四代EGFR-TKIs、EGFR/cMET雙抗產(chǎn)品管線,在EGFR突變的非小細(xì)胞肺癌領(lǐng)域積累了豐富的經(jīng)驗(yàn),為助力CFT8919片后續(xù)研發(fā)奠定了堅(jiān)實(shí)基礎(chǔ)。亞洲EGFR L858R突變患病人群較多,存在較大的未被滿足的臨床用藥需求。期待CFT8919片早日開展臨床研究,為全球患者提供新的治療選擇。
下一條: 中央統(tǒng)戰(zhàn)部副部長、國僑辦主任陳旭一行調(diào)研貝達(dá)藥業(yè)
