貝達藥業的新藥鹽酸恩莎替尼于2019年2月15日被國家藥品監督管理局(NMPA)藥品審評中心(CDE)納入擬優先審評品種公示名單,現公示期滿,將正式進入優先審評程序。此前,鹽酸恩莎替尼國內藥品注冊申請已于2018年12月26日獲得NMPA受理。
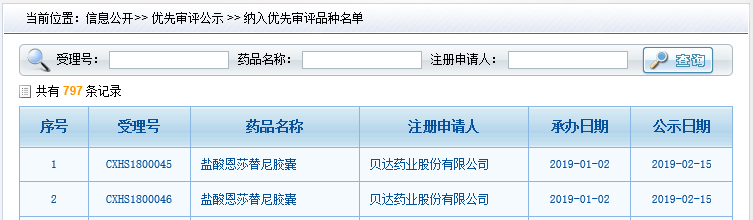
CDE網站公示信息
鹽酸恩莎替尼是一種新型強效、高選擇性的新一代ALK抑制劑,是貝達藥業和控股子公司Xcovery共同開發的全新的、擁有完全自主知識產權的創新藥,用于接受過克唑替尼治療后進展的或者對克唑替尼不耐受的ALK陽性的局部晚期或轉移性非小細胞肺癌(NSCLC)患者提供新的治療。同時,公司已在國內外就鹽酸恩莎替尼開展了多項臨床研究,其中鹽酸恩莎替尼一線治療ALK陽性NSCLC患者的全球多中心III期臨床試驗正在順利推進中,鹽酸恩莎替尼有望成為第一個由中國公司主導的在全球同步上市的自主創新藥。
鹽酸恩莎替尼作用機理
優先審評制度是為了加強藥品注冊管理,加快具有臨床價值新藥的上市進度,解決藥品注冊申請積壓的矛盾而提出的。該制度充分貫徹了中辦、國辦《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》精神,在國務院《關于改革藥品醫療器械審評審批制度的意見》指導下設立。2017年12月,《關于鼓勵藥品創新實行優先審評審批的意見》發布。對于被納入優先審評的品種,藥政管理部門將優先審評和核查資源,有效縮短藥品所需的審批時限。
貝達藥業副總裁馬勇斌表示:“非常高興聽到這個好消息。鹽酸恩莎替尼被納入優先審評品種,不僅是對鹽酸恩莎替尼臨床價值的肯定,也體現出國家對自主創新藥研發的大力支持,將大大加快鹽酸恩莎替尼的上市進程,使其能夠更早惠及中國百姓。”今后,貝達將秉承開拓創新,造福于民的發展理念,努力為老百姓研制更多用得起的新藥、好藥。
關于鹽酸恩莎替尼
鹽酸恩莎替尼是一種全新、高效的新一代ALK抑制劑,目前的臨床研究結果顯示鹽酸恩莎替尼對克唑替尼耐藥的ALK陽性非小細胞肺癌患者有良好的療效和安全性。整體療效和顱內療效均達到預期指標,在克唑替尼耐藥的ALK陽性非小細胞肺癌患者中安全耐受性良好,具有良好可控的安全性,可為中國ALK陽性的NSCLC患者帶來一種新的有效的治療選擇。目前尚無針對該靶點的國產創新藥物上市,鹽酸恩莎替尼的上市將填補國內的空白。
關于貝達藥業
貝達藥業(300558.SZ)是一家由海歸博士團隊創辦,以自主知識產權創新藥物研究和開發為核心,集研發、生產、營銷于一體的國家級高新技術企業。自主研發了中國第一個小分子靶向抗癌藥——鹽酸埃克替尼(商品名:凱美納),被譽為堪比民生領域“兩彈一星”的重大突破,兩獲中國專利金獎,斬獲我國化學制藥行業第一個國家科技進步一等獎。截至目前,埃克替尼已惠及近20萬名晚期肺癌患者,累計銷售超57億元。公司建立了完整的新藥研發體系,在杭州、北京分別設有研發中心,在研創新藥30余項,涵蓋了肺癌、腎癌、乳腺癌等多個腫瘤適應癥。公司還先后與Amgen、Xcovery、Tyrogenex、Merus、天廣實、益方生物等國內外領先的制藥企業達成戰略合作,為促進全人類的健康福祉而共同努力。
下一條: 新年喜訊!貝達藥業自主研發的BPI-17509獲批開展臨床試驗
