
3月3日,貝達藥業收到國家藥品監督管理局簽發的《受理通知書》(受理號:CXHS2100008國),甲磺酸貝福替尼膠囊(BPI-D0316)擬用于既往使用EGFR-TKI耐藥后產生T790M突變的局部晚期或轉移性非小細胞肺癌治療的上市許可申請獲得受理。
EGFR是一組具有酪氨酸激酶活性的表皮生長因子家族的細胞表面受體,其活化異常可激活與腫瘤增殖、分化相關的基因,繼而誘發腫瘤的形成和發展。EGFR抑制劑通過抑制EGFR的激酶活性,阻斷EGFR信號通路,從而產生抑制腫瘤細胞的增殖、轉移并促進腫瘤細胞發生凋亡等一系列生物學效應。目前針對EGFR突變非小細胞肺癌的治療,以第一代EGFR-TKI為主,包括貝達開發的鹽酸埃克替尼。病人在接受治療一年左右會出現耐藥,其中50%以上的病人因T790M突變。甲磺酸貝福替尼膠囊是針對T790M突變的第三代EGFR-TKI,具有巨大的臨床需求。
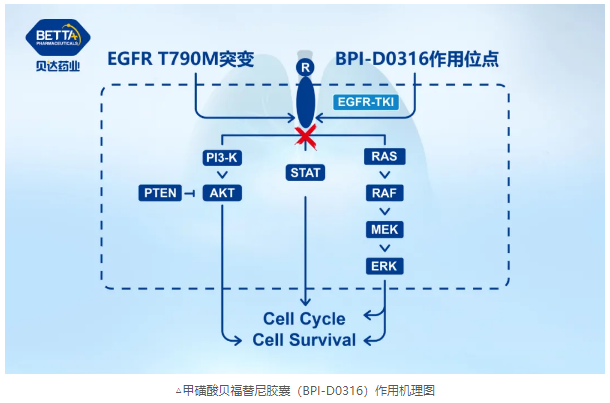
甲磺酸貝福替尼膠囊 II期臨床研究由上海市胸科醫院陸舜教授牽頭完成。研究采用75-100mg甲磺酸貝福替尼治療一代EGFR-TKI耐藥后產生T790M突變的局部晚期或轉移性非小細胞肺癌患者。經獨立評審委員會(IRC)評估的客觀緩解率(ORR)為64.8%,疾病控制率(DCR)為95.2%。34例基線有顱內靶病灶的腦轉移受試者顱內客觀緩解率(iORR)為52.9%,顱內疾病控制率(iDCR)為97.1%。無進展生存期(PFS)數據尚未成熟,待進一步隨訪獲得后補充遞交。安全性方面,治療期間受試者不良反應發生率為91.0% ,不良反應大多為1級或2級,最常見的為血小板減少癥、頭痛、白細胞計數降低、貧血、皮疹等。3級及以上不良反應主要為血小板減少癥,經短期停藥和/或對癥治療等可恢復或緩解。該研究為甲磺酸貝福替尼膠囊申請條件性獲批提供了療效和安全性依據。

貝達藥業副總裁蔡萬裕表示,甲磺酸貝福替尼是貝達藥業與益方生物協作開發的項目。在開發過程中,雙方承前啟后,協同作戰,克服了眾多困難,終于完成從動物到人體的全程研究,取得令人興奮的臨床結果,并已完成產業化,成為貝達藥業繼鹽酸埃克替尼、鹽酸恩沙替尼、貝伐珠單抗(MIL60)后第4個申請上市的新藥。
益方生物董事長王耀林博士表示,甲磺酸貝福替尼上市申請的成功受理,標志著益方生物和貝達藥業的合作達到了一個新的里程碑。該合作既充分證明了益方生物早期研發強大的創新能力,也再次體現了貝達藥業后期臨床和注冊高效的執行能力。我期待這款強強聯合開發出的新藥早日上市,為患者提供更多、更好的藥物選擇。
貝達藥業副總裁馬勇斌表示,甲磺酸貝福替尼上市申請獲受理的背后,凝聚了戰略合作、醫學、注冊事務、質量、生產等公司各個部門的心血。接下來,我們將全力做好審評期間的相關工作,盡早獲批上市,為第一代EGFR-TKI耐藥的T790M突變非小細胞肺癌患者提供新的用藥選擇。
貝達藥業聚焦肺癌靶向藥的研究開發,甲磺酸貝福替尼將與公司已上市的鹽酸埃克替尼(第一代EGFR-TKI)、恩沙替尼(ALK靶點),在研的BPI-361175(第四代EGFR-TKI)、MCLA-129(EGFR/c-Met雙特異性抗體)、BPI-21668(PI3Kα抑制劑)組合發力,針對肺癌病人不同靶點和不同的耐藥突變,提供対應的治療藥物,滿足其臨床需求,讓這些肺癌患者活得更長,更好。
下一條: 恩沙替尼II期研究動態ctDNA分析結果在JTO發表
