新聞中心 / News Center
貝達藥業巴替利單抗(PD-1抗體)注射液獲批開展臨床試驗
日期: 2021-06-10

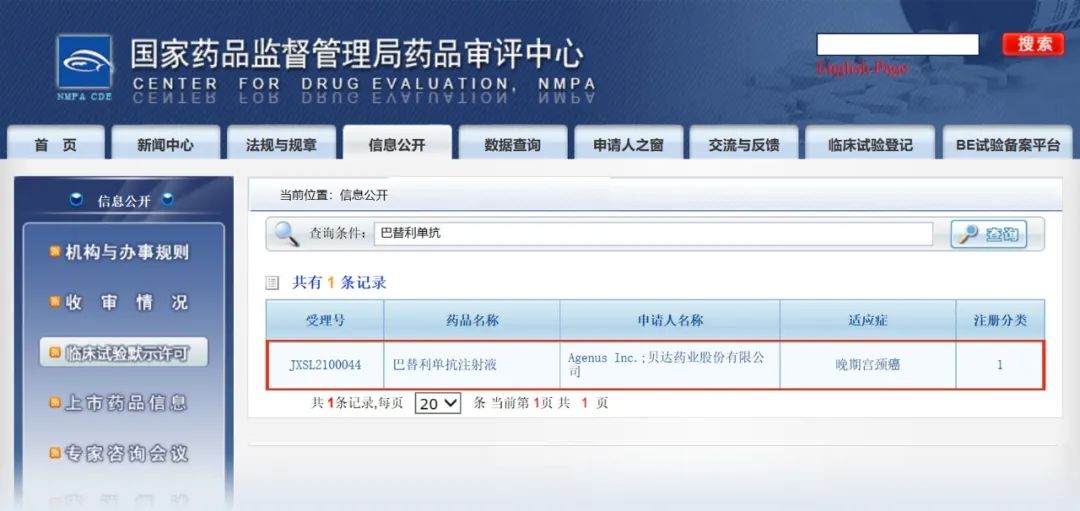
6月10日,貝達藥業收到國家藥品監督管理局簽發的《藥物臨床試驗批準通知書》(通知書編號:2021LP00858),公司和Agenus Inc.共同申報的評價巴替利單抗注射液(Balstilimab,PD-1抗體)單獨或聯合澤弗利單抗注射液(Zalifrelimab,CTLA-4抗體)治療晚期宮頸癌的臨床試驗已獲得國家藥品監督管理局批準。
巴替利單抗(PD-1抗體)和澤弗利單抗(CTLA-4抗體)項目是貝達藥業通過戰略合作引進的項目。2020年6月,貝達藥業宣布與Agenus Inc.達成合作,取得在中國區域內(包括香港、澳門和臺灣)單用或聯合其他藥物治療除膀胱內給藥外的所有適應癥上的獨家開發并商業化巴替利單抗(PD-1抗體)和澤弗利單抗(CTLA-4抗體)的權利。
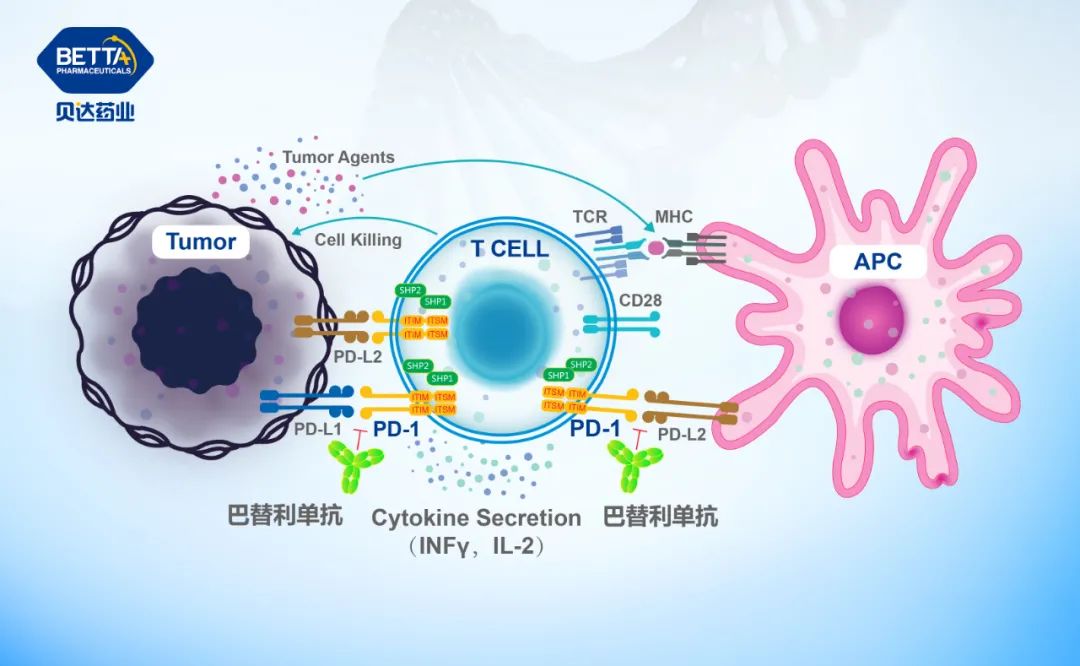
△巴替利單抗(PD-1抗體)作用機理圖
巴替利單抗(PD-1抗體)是Agenus開發的腫瘤免疫單克隆抗體,是一種與程序性死亡受體1(PD-1)相結合的重組單克隆抗體,具有抑制PD-1與其配體(PD-L1、PD-L2)結合的能力。PD-1自身可以促進淋巴結中抗原特異性T細胞的凋亡(即程序性細胞死亡),也可以減少調節性T細胞(抗炎的抑制性T細胞)的凋亡,以此來負調節免疫反應。而巴替利單抗是一種有效的PD-1拮抗劑抗體,通過抑制PD-1的功能來激活免疫系統以攻擊腫瘤。
巴替利單抗(PD-1抗體)單藥或巴替利單抗(PD-1抗體)聯合澤弗利單抗(CTLA-4抗體)擬用于晚期宮頸癌患者的治療。
下一條: 重磅!貝達藥業埃克替尼術后輔助治療獲批上市
熱門點擊
