貝達藥業FGFR4 抑制劑BPI-43487項目I期臨床研究首例受試者入組
日期: 2021-09-02
9 月 2 日,貝達藥業 BPI-43487 項目 I 期臨床研究第一例受試者成功入組,順利完成首次給藥。該研究全稱為“BPI-43487 膠囊在晚期實體瘤患者中的 Ⅰ 期臨床研究”,主要研究者為北京腫瘤醫院沈琳教授。I 期研究包括劑量遞增和擴大入組兩部分,主要目標是評估 BPI-43487 膠囊在晚期實體瘤患者中的安全性和耐受性,確定 II 期推薦劑量(RP2D)。
BPI-43487 是由貝達藥業自主研發的擁有完全自主知識產權的小分子化合物,是一個全新結構的高選擇性的 FGFR4 激酶抑制劑,擬治療攜帶FGF19 擴增、FGF19 過表達或 FGFR4 過表達的肝細胞癌/膽管細胞癌等實體瘤。
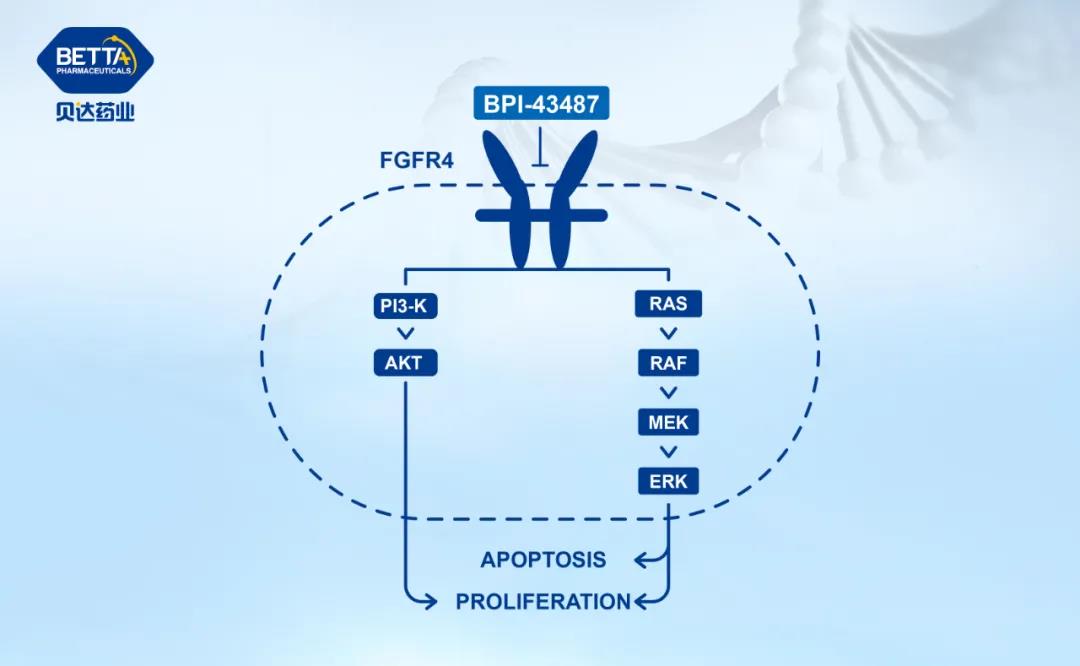
△BPI-43487作用機理圖
根據化學藥品注冊分類改革工作方案公告,BPI-43487膠囊為“境內外均未上市的創新藥”,其注冊分類為化學藥品 1 類。2020 年 12 月,貝達藥業收到國家藥品監督管理局(NMPA)簽發的《藥物臨床試驗批準通知書》(通知書編號: 2020LP00879、2020LP00880),BPI-43487 膠囊符合藥品注冊相關法規要求,同意按照提交的方案開展實體瘤的臨床研究。
貝達藥業資深副總裁兼首席科學家王家炳博士表示,到目前為止,國內外均無特異性靶向 FGFR4 的小分子抑制劑上市。BPI-43487作為新型強效、選擇性 FGFR4 小分子口服抑制劑,可通過特異性不可逆結合到 FGFR4 激酶結構域的 ATP 結合位點來抑制 FGFR4 催化活性,降低其下游蛋白的磷酸化水平,阻斷下游調控腫瘤細胞增殖、存活的信號通路的激活,從而達到抗腫瘤作用。臨床前研究結果顯示其具有良好的安全性、耐受性、選擇性和抗腫瘤活性,期待該藥物在臨床研究中取得良好進展,早日使患者獲益。
下一條: 貝達藥業BPI-23314片治療惡性血液系統腫瘤獲批開展臨床試驗
熱門點擊
