11月29日,貝達藥業收到國家藥監局(NMPA)核準簽發的《藥品注冊證書》(藥品批準文號:國藥準字S20210047),貝伐珠單抗注射液(MIL60,商品名:貝安汀?)正式獲批上市,獲批的適應癥為轉移性結直腸癌和晚期、轉移性或復發性非小細胞肺癌。
肺癌是中國死亡率和發病率均排名第一的惡性腫瘤疾病,其中非小細胞肺癌(NSCLC)約占肺癌的80%-85%。而在中國常見新發癌癥中,結直腸癌的總體發病率已升至第三位,并居常見癌癥死亡原因的第五位。
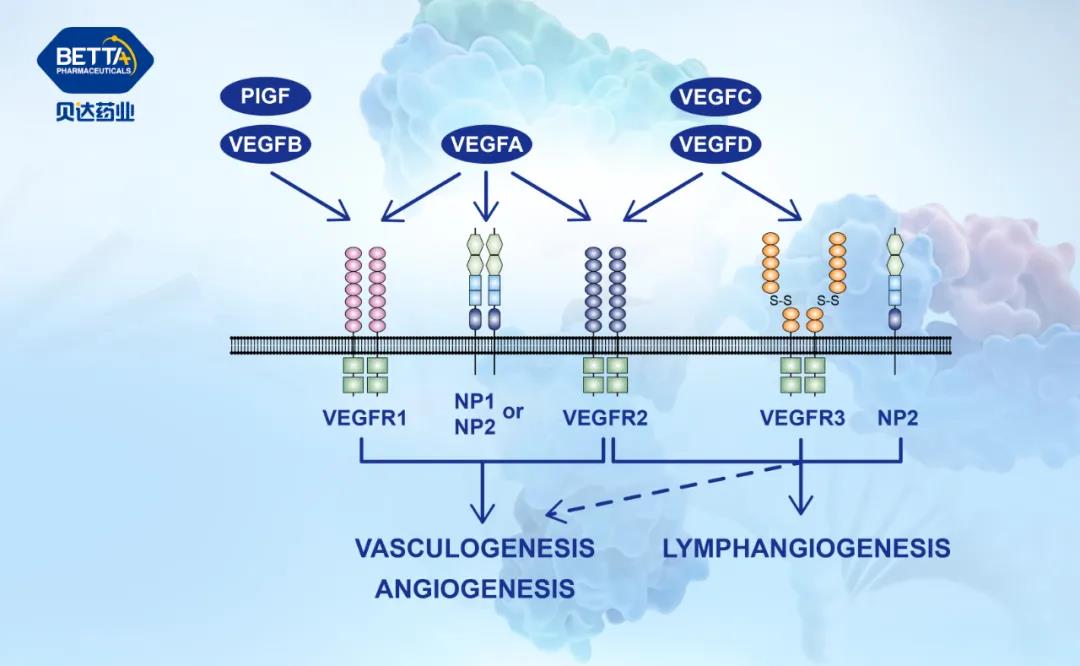
△貝伐珠單抗注射液作用機理圖
貝伐珠單抗是一種重組的人源化單克隆抗體,可以選擇性地與人血管內皮生長因子(VEGF)結合并阻斷其生物活性,減少腫瘤的血管形成,從而抑制腫瘤的生長。貝伐珠單抗原研藥安維汀?于2015年7月9日獲NMPA批準,在與卡鉑和紫杉醇聯合應用時,可作為一線治療用于不可切除的晚期、轉移性或復發性非鱗狀NSCLC患者。

2017年2月,貝達藥業與北京天廣實生物技術股份有限公司就貝伐珠單抗注射液項目達成合作,受托生產企業為浙江博銳生物制藥有限公司(以下簡稱“博銳生物”)下屬子公司海正生物制藥有限公司。2019年12月,貝伐珠單抗注射液(MIL60)III臨床研究達到主要研究終點。該項目是比較MIL60和安維汀聯合紫杉醇和卡鉑治療晚期或復發性非鱗狀非小細胞肺癌(NSCLC)初治受試者的有效性和安全性的隨機、雙盲、多中心III期研究,由中國醫學科學院腫瘤醫院王潔教授牽頭,全國50家研究中心參與。2020年6月,MIL60上市許可申請獲得國家藥品監督管理局受理。2021年9月,MIL60 III期臨床研究成果亮相2021年歐洲腫瘤內科學會(ESMO)年會。
貝達藥業董事長兼首席執行官丁列明博士表示,貝安汀?遵循生物類似藥嚴謹的研發途徑,不僅通過了全面的質量相似性研究、非臨床相似性研究,而且在在PK特征、臨床有效性、安全性和免疫原性等方面表現出與安維汀?高度的相似性。貝安汀?以高品質、高可及性的特點,為轉移性結直腸癌和晚期、轉移性或復發性非小細胞肺癌患者提供了與原研藥物等效優質的治療選擇。
貝達藥業副總裁馬勇斌表示,貝安汀?是貝達藥業第三個獲批上市的藥物,是公司首個按藥品上市許可持有人(MAH)制度申報的品種,也是首個獲批的大分子生物制品,它的成功上市標志著貝達藥業向大分子抗癌領域邁進了一大步,進一步豐富了公司產品管線。
北京天廣實生物技術股份有限公司董事長、總經理李鋒博士表示:“非常欣喜看到貝達藥業和天廣實生物共同開發的貝安汀?在中國成功獲批上市。貝安汀?在藥學、臨床前、和I期臨床研究中均顯示與貝伐珠單抗高度類似,III期臨床結果進一步確證國產抗體類似物與進口原研藥療效一致,期待它為腫瘤患者帶來更多選擇,讓更多患者獲得更長生存和更好的生活質量。”
博銳生物總裁王海彬博士表示,很高興貝安汀?獲批上市,為患者提供新的治療選擇。未來博銳生物將深化與貝達藥業的合作,共同研制出更多放心好藥,惠及更多患者,共同助力健康中國建設。
下一條: 貝達藥業SHP2抑制劑BPI-442096藥品臨床試驗申請獲受理
