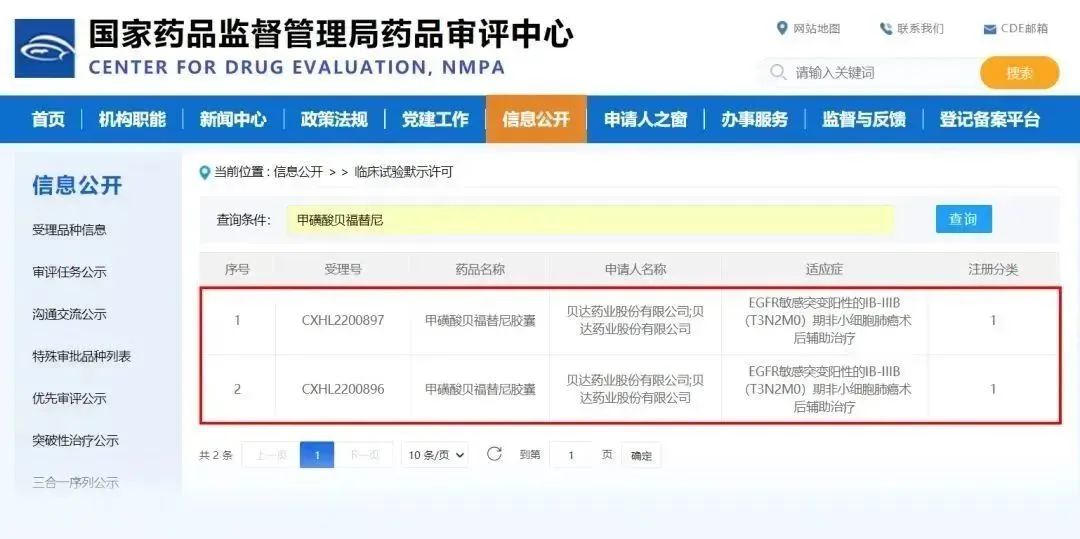
近日,貝達藥業收到國家藥品監督管理局簽發的《藥物臨床試驗批準通知書》(通知書編號:2023LP00192;2023LP00193),公司申報的甲磺酸貝福替尼膠囊擬用于“EGFR敏感突變陽性的IB-IIIB(T3N2M0)期非小細胞肺癌術后輔助治療”適應癥獲批開展臨床試驗。研究設計與貝達藥業自主研發的首個國產第一代EGFR抑制劑埃克替尼對照,開展一項隨機、雙盲、雙模擬的III期臨床研究。
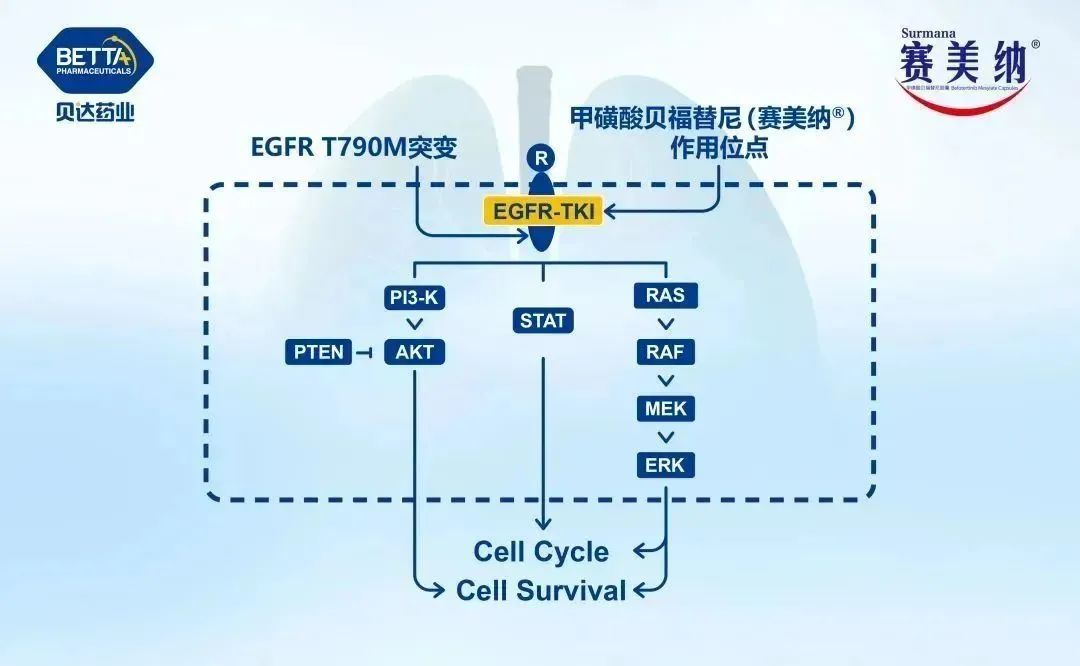
△甲磺酸貝福替尼膠囊(BPI-D0316)作用機理圖
甲磺酸貝福替尼膠囊是第三代表皮生長因子受體酪氨酸激酶抑制劑(EGFR-TKI),其NSCLC一線、二線治療適應癥目前均在NDA審評過程中,此次是貝福替尼開展的第三項適應癥研究。
貝達藥業副總裁季東表示,肺癌術后輔助治療可以進一步減少復發、延長患者生存,對于EGFR突變陽性的NSCLC患者,EGFR-TKI已成為早期可切除肺癌患者的標準治療手段。基于此前貝福替尼在NSCLC一線治療中取得的亮眼成績,本次研究勇于打破同類第三代EGFR-TKI術后輔助與安慰劑對照的傳統局面,研究設計貝福替尼將與權威指南推薦的埃克替尼作為對照,針對NSCLC術后輔助治療臨床試驗結果更加值得期待。
貝達藥業副總裁王三虎表示,貝福替尼優異的療效與安全性已在二線、一線NSCLC人群中獲得印證,此次NSCLC術后輔助臨床試驗申請的批準標志著貝福替尼將有希望造福更多EGFR陽性的NSCLC患者,貝達藥業將全力推進貝福替尼全線適應癥的注冊工作,深度發掘更多治療潛能,期待貝福替尼早日惠及中國廣大NSCLC患者。
貝達藥業資深副總裁蔡萬裕表示,作為國內靶向抗癌藥的探路者,貝達藥業自主創制的國內首款第一代EGFR-TKI埃克替尼于2011年獲批上市,并于2021年再次取得NSCLC術后輔助治療適應癥的批準。此次第三代EGFR-TKI貝福替尼術后輔助適應癥臨床申請的獲批,代表著貝達藥業在靶向抗癌創新藥領域的又一次傳承。
下一條: 貝達藥業甲磺酸貝福替尼膠囊(賽美納?)非小細胞肺癌一線治療上市申請獲受理
