近日,貝達藥業收到國家藥品監督管理局簽發的《受理通知書》,公司申報注射用MCLA-129(受理號:CXSL2300322)和甲磺酸貝福替尼膠囊(受理號:CXHL2300494、CXHL2300495)聯合用藥臨床試驗申請已獲得國家藥品監督管理局受理。
本次注射用MCLA-129聯合甲磺酸貝福替尼膠囊臨床試驗申請,擬用于具有表皮生長因子受體(EGFR)外顯子19缺失或外顯子21(L858R)置換突變的局部晚期或轉移性非小細胞肺癌(NSCLC)成人患者的治療。
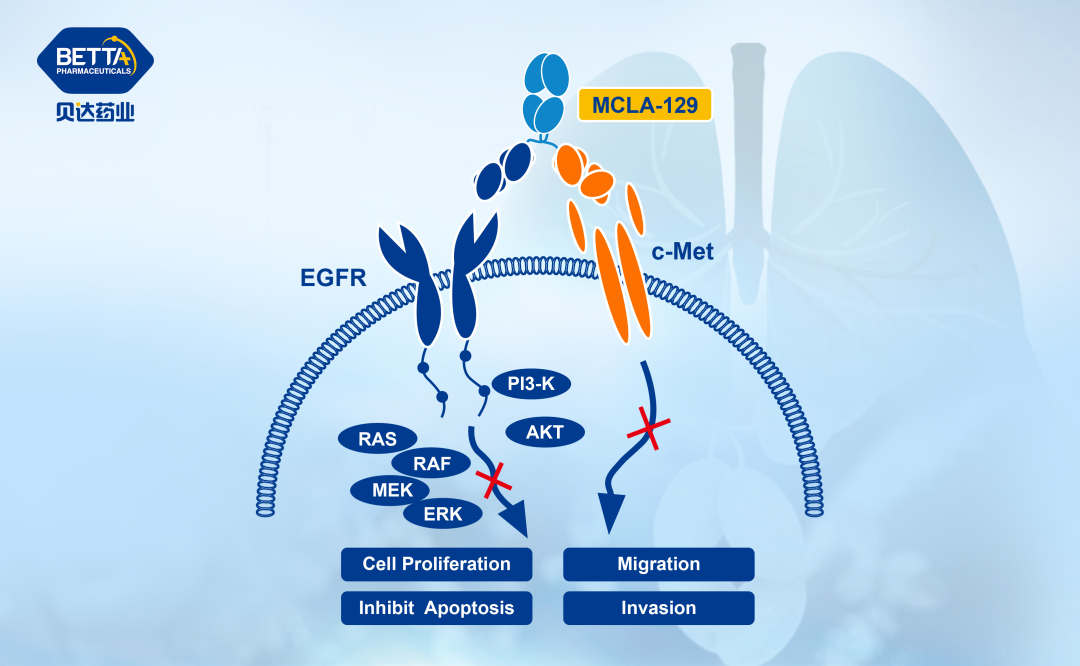
△MCLA-129作用機理圖
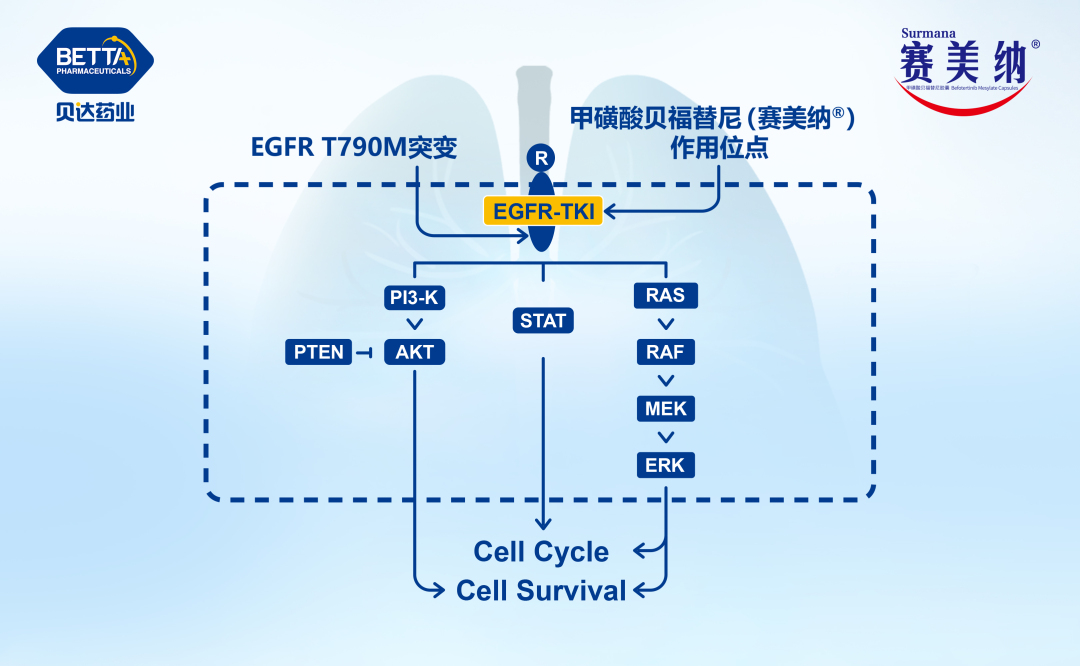
△甲磺酸貝福替尼膠囊作用機理圖
MCLA-129是一款針對表皮生長因子受體(EGFR)和細胞間質上皮轉化因子(c-Met)雙靶點的雙特異性抗體,可同時阻斷EGFR和c-Met的信號傳導,抑制腫瘤的生長和存活,且可經增強的抗體依賴的細胞介導的細胞毒性作用(ADCC)進一步提高對腫瘤細胞的殺傷潛能。其擬用于“EGFR或MET異常的晚期實體瘤患者的治療”的臨床試驗申請已獲批準,并在開展相關臨床研究。
甲磺酸貝福替尼膠囊是第三代表皮生長因子受體酪氨酸激酶抑制劑(EGFR-TKI)。其用于EGFR突變陽性非小細胞肺癌的一線、二線適應癥目前均在上市許可審評中,用于術后輔助治療的臨床試驗申請已獲批準,正在開展相關臨床研究。
貝達藥業副總裁季東表示,此次貝福替尼聯合MCLA-129,有望進一步改善EGFR敏感突變初治以及EGFR-TKI耐藥的非小細胞肺癌患者的臨床獲益,延長無疾病進展時間和生存期,滿足晚期非小細胞肺癌治療領域未被滿足的臨床需求。
貝達藥業副總裁王三虎表示,晚期非小細胞肺癌治療領域仍存在未被滿足的臨床需求,貝達擁有三代EGFR-TKI以及EGFR/c-Met雙特異性抗體。本次是充分考慮聯合用藥獲益風險后提出的臨床試驗申請。
關于MCLA-129
MCLA-129項目是貝達藥業通過戰略合作引進的項目。2019年1月,貝達藥業與荷蘭Merus公司宣布就MCLA-129項目達成戰略合作,獲得Merus公司獨家授權許可MCLA-129項目在中國的開發和商業化權益,Merus公司保留中國以外的全球權益。
關于Merus
Merus是一家以腫瘤治療藥物臨床開發為核心的公司,擁有開發創新全人源雙特異性和三特異性抗體的治療藥物技術平臺Multiclonics?。Multiclonics?使用行業標準方法生產制備抗體,并且在臨床前和臨床研究中發現該平臺制備的抗體與常規單克隆抗體有相似的特征,例如,長半衰期和低免疫原性。
下一條: 浙江省公安廳副廳長魏明一行赴貝達藥業走訪巡查
