貝達藥業(yè)口服PD-L1抑制劑BPI-371153膠囊藥品獲批開展臨床試驗
日期: 2022-01-16
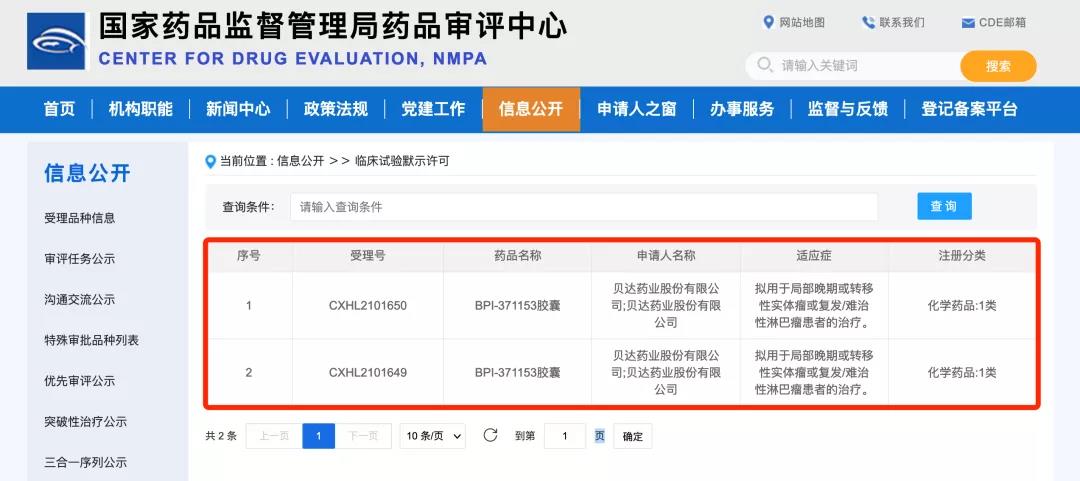
近日,貝達藥業(yè)收到國家藥品監(jiān)督管理局簽發(fā)的《藥物臨床試驗批準通知書》(通知書編號:2022LP00057;2022LP00060),公司申報的BPI-371153膠囊的藥品臨床試驗申請已獲國家藥品監(jiān)督管理局批準開展。
BPI-371153是由貝達藥業(yè)自主研發(fā)的新分子實體化合物,屬于新型強效、高選擇性的口服小分子PD-L1(Programmed Cell Death 1 Ligand 1)抑制劑。本品擬用于局部晚期或轉(zhuǎn)移性實體瘤或復(fù)發(fā)/難治性淋巴瘤患者的治療。
臨床前數(shù)據(jù)顯示,BPI-371153可有效誘導(dǎo)和穩(wěn)定PD-L1二聚體的形成及內(nèi)吞,從而強有力地阻斷PD-L1/PD-1相互作用。臨床前研究中展現(xiàn)出優(yōu)秀的體外及體內(nèi)活性、良好的安全性及藥代動力學性質(zhì)。
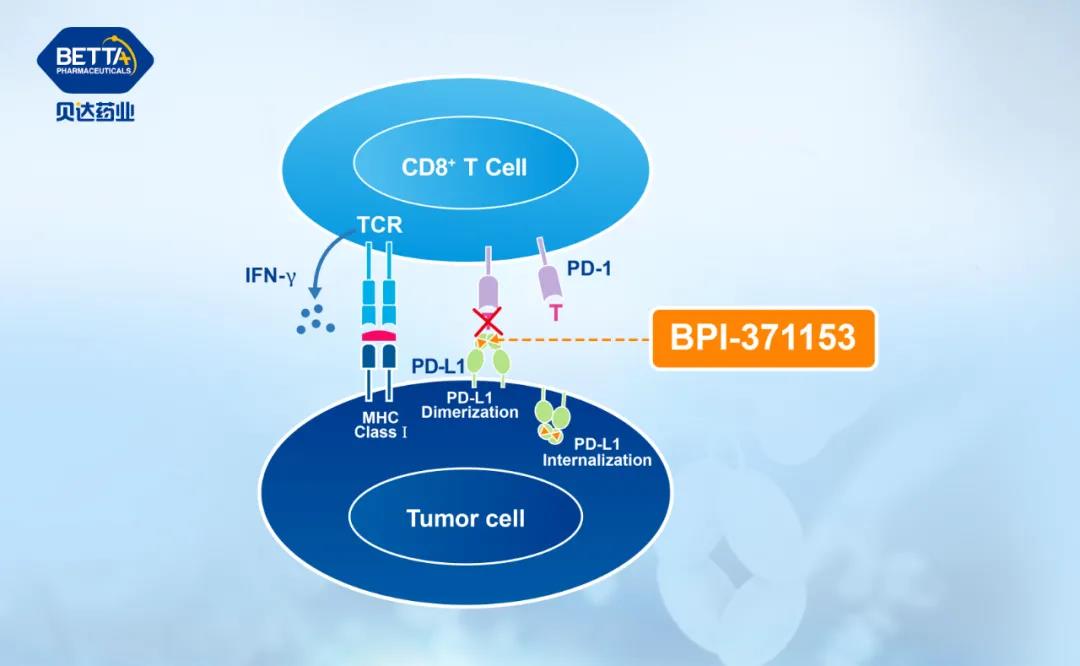
△BPI-371153作用機理圖
貝達藥業(yè)副總裁兼北京研發(fā)中心主任蘭宏博士表示,截至目前,全球尚無獲批或已上市的PD-L1小分子抑制劑,BPI-371153有望成為全球首批上市的小分子PD-L1抑制劑。相較于單克隆抗體,小分子PD-L1抑制劑可口服,提高患者的依從性,在生產(chǎn)工藝、劑型及給藥方式等多種層面的研究也較為成熟,且成本低,同時也可避免大分子藥物引起的免疫原性反應(yīng)。其口服給藥這一特點,未來在聯(lián)合用藥中將展現(xiàn)出極強的競爭優(yōu)勢,具有巨大的市場潛力。我們將繼續(xù)做好后續(xù)工作,期待BPI-371153能夠早日獲批上市,惠及患者。
下一條: 貝達藥業(yè)伏羅尼布片(CM082)上市申請獲受理
熱門點擊
Copyright © 2019 版權(quán)所有 貝達藥業(yè)股份有限公司 (浙)-非經(jīng)營性-2023-0062 浙ICP備11052940號-2

