1月24日,貝達藥業收到國家藥品監督管理局簽發的《藥物臨床試驗批準通知書》(通知書編號:2022LP00095;2022LP00096),公司申報的BPI-442096片擬用于晚期實體瘤的藥品臨床試驗申請已獲國家藥品監督管理局批準開展。
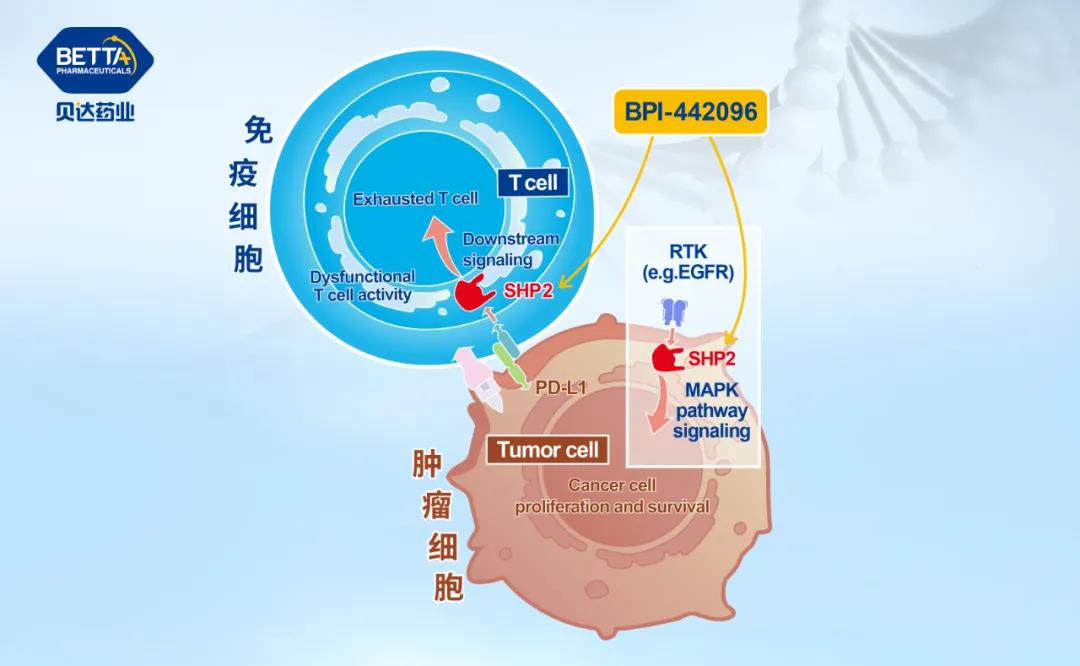
△BPI-442096作用機理圖
BPI-442096是一個由貝達藥業股份有限公司自主研發的擁有完全自主知識產權的新分子實體化合物,是一種新型強效、高選擇性的含Src 同源2結構域蛋白酪氨酸磷酸酶(Src homology region 2 domain-containing phosphatase-2,SHP2)口服小分子抑制劑。BPI-442096通過特異性靶向SHP2蛋白變構位點抑制SHP2活化,從而抑制包括RAS-MAPK、PD-L1/PD-1等信號傳導途徑,進而抑制腫瘤細胞的增殖、生長、存活、運動和代謝等,最終達到抑制腫瘤生長的目的。目前尚無SHP2抑制劑上市。
BPI-442096將單藥用于KRAS突變、BRAF第三類突變、NF1 LOF突變以及RTK突變、擴增或重排等基因異常的組織學或細胞學確診的局部晚期或轉移性的實體瘤患者,包括非小細胞肺癌、胰腺癌、結直腸癌患者或其他確診的實體瘤患者。
貝達藥業杭州研發中心主任吳顥博士表示,臨床前研究顯示,BPI-442096作用機理明確,體內外生物學活性一致,在多種腫瘤移植瘤模型上展示了顯著的抗腫瘤活性。同時BPI-442096與其它機制相關藥物聯用還可以帶來更好的抗腫瘤效果,提示其具有廣泛的臨床應用前景。臨床前藥代動力學和毒理學研究結果顯示BPI-442096在多種屬上有較高的口服生物利用度,較大的安全窗,支持其進入下一步的臨床實驗。我們將做好后續工作,期待BPI-442096能夠早日獲批上市,惠及患者。
下一條: 貝達藥業口服PD-L1抑制劑BPI-371153膠囊藥品獲批開展臨床試驗
